Enlaces químicos o uniones químicas: Iónicos, Covalentes, Metálicos.
➡️ Vamos a empezar a estudiar los enlaces químicos (también llamados uniones químicas). Es decir, nos vamos a enfocar en cómo son esos enlaces, qué tipos hay, cómo se denominan y qué características tienen, entre qué tipos átomos se forman, etc. ¿Y por qué queremos saber ésto? Porque esto es clave para lo que se viene: las fuerzas intermoleculares. Peeeero no te quiero spoilear demasiado, así que vamo´ a los bifes (perdonen mis alumnxos extranjerxs, si hay alguna expresión que no entienden, pregunten y en comentarios sus compañerxs y yo lxs vamos a guiar).
La formación de una unión química o de un enlace químico implica un reordenamiento de los electrones de valencia de los átomos que se unen, para dar lugar a una estructura de menor energía y por lo tanto más estable. Esto significa que en el proceso de unión entre dos átomos se libera cierta cantidad de energía (energía de enlace), y es esa misma cantidad de energía la que uno tiene que entregar a ese enlace para romperlo. No es que se unen por amor (lo siento si pensabas que era así jeje), sino que se unen porque son energéticamente más estables unidos que separados.
👉 Un concepto importante a tener en cuenta en este asunto de las uniones químicas es el de la electronegatividad de los átomos.
La electronegatividad es una medida de la tendencia de un átomo a atraer hacia sí los electrones cuando forma un enlace químico en una molécula. Los valores de electronegatividad son útiles para predecir el tipo de enlace que se formará entre dos elementos, y no los tenés que saber de memoria, están en la tabla periódica y lo vamos a ir viendo en los videos.

Espero que te sirva este resumen, podés volver acá cuando quieras. ¡Muchos ánimos y muchos éxitos!
La formación de una unión química o de un enlace químico implica un reordenamiento de los electrones de valencia de los átomos que se unen, para dar lugar a una estructura de menor energía y por lo tanto más estable. Esto significa que en el proceso de unión entre dos átomos se libera cierta cantidad de energía (energía de enlace), y es esa misma cantidad de energía la que uno tiene que entregar a ese enlace para romperlo. No es que se unen por amor (lo siento si pensabas que era así jeje), sino que se unen porque son energéticamente más estables unidos que separados.
👉 Un concepto importante a tener en cuenta en este asunto de las uniones químicas es el de la electronegatividad de los átomos.
La electronegatividad es una medida de la tendencia de un átomo a atraer hacia sí los electrones cuando forma un enlace químico en una molécula. Los valores de electronegatividad son útiles para predecir el tipo de enlace que se formará entre dos elementos, y no los tenés que saber de memoria, están en la tabla periódica y lo vamos a ir viendo en los videos.
Los elementos con alta electronegatividad tienden a atraer electrones más fuertemente, y los elementos con baja electronegatividad los atraen más débilmente, así de simple es el concepto, no dejes que nadie te asuste con cosas más rebuscadas.
Si querés saber cómo varía la electronegatividad en el período y en el grupo de la tabla periódica, te recomiendo el apunte de Electronegatividad.
👉 Otro concepto a considerar son los electrones de valencia, que básicamente son los electrones más externos de un átomo. ¿Por qué son importantes? Porque son los que participan en las interacciones químicas y determinan las propiedades químicas del elemento. Son tan importantes que incluso la cantidad de electrones de valencia tiene que ver con el orden de los elementos en la tabla periódica, o sea..💅
Lo que tenés que saber es que son los electrones que están ubicados en el nivel de energía más externo del átomo, es decir que son los que están más alejados del núcleo.
➡️ Al momento en que los átomos crean una unión ellos pueden estar, cediendo o aceptando electrones (compuestos iónicos), o compartiéndolos (compuestos moleculares). Tranqui que ahora te lo explico👇
✨Tipos de enlaces o uniones químicas✨
Podemos clasificar a los enlaces según la diferencia de las electronegatividades entre los átomos enlazados.
Hay tres tipos: Enlace iónico (cuando la diferencia de electronegatividad es grande), enlace covalente (cuando dicha diferencia es pequeña o nula e involucra a no metales) y enlace metálico (cuando dicha diferencia es pequeña o nula e involucra a metales, por eso el nombre).
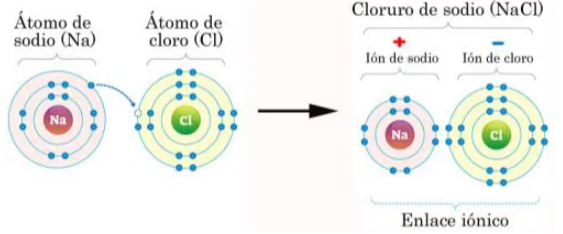
• Enlace iónico: Ocurre cuando hay una transferencia completa de electrones de un átomo a otro, típicamente se da entre un metal y un no metal de alta electronegatividad (porque ahí la diferencia de electronegatividad entre los átomos enlazados es grande). Esto resulta en la formación de iones con cargas opuestas que se atraen electrostáticamente. Por ejemplo, en el cloruro de sodio (NaCl), el sodio (Na) cede un electrón al cloro (Cl), formando iones Na+ y Cl^-. Y lo que se obtiene no es una molécula, sino que se le llama "unidad fórmula". Se llama así, no me preguntes por qué jaja, yo le hubiese puesto Daiana, pero bueh.

• Enlace covalente: Se da cuando dos átomos comparten uno o más pares de electrones, típicamente entre no metales. La compartición puede ser igual, donde los electrones están a la misma distancia de ambos átomos (enlace covalente no polar) o desigual, donde los electrones están más cerca del átomo más electronegativo (enlace covalente polar), dependiendo de la electronegatividad de los átomos involucrados.
Además, según la cantidad de electrones que compartan podemos tener enlaces covalentes simples (donde cada átomo aporta un electrón al enlace), enlaces dobles (donde cada átomo aporta 2 electrones al enlaces) y enlaces triples (donde cada átomo aporta tres electrones al enlace)
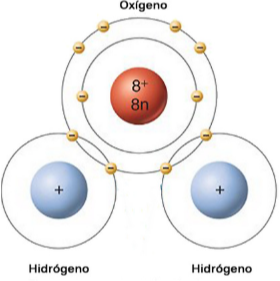
Un ejemplo de esto es la molécula de agua. Donde un átomo de oxígeno (O) comparte forma dos enlaces simples con cada hidrógeno (H). Cada átomo aporta un electrón a su enlace.
Además, según la cantidad de electrones que compartan podemos tener enlaces covalentes simples (donde cada átomo aporta un electrón al enlace), enlaces dobles (donde cada átomo aporta 2 electrones al enlaces) y enlaces triples (donde cada átomo aporta tres electrones al enlace)
Un ejemplo de esto es la molécula de agua. Donde un átomo de oxígeno (O) comparte forma dos enlaces simples con cada hidrógeno (H). Cada átomo aporta un electrón a su enlace.

• Enlace metálico: Es el tipo de enlace que se encuentra en los metales, donde los átomos de metal liberan algunos de sus electrones, creando una "mar de electrones" (imaginá conmigo, dale) que fluye libremente entre los iones metálicos positivamente cargados. Esto confiere a los metales ese brillo tan característico, su maleabilidad y su conductividad eléctrica.

Entonces, en base a las uniones químicas también podemos tener presente el tipo de sustancia que se forma:
| Tipo de sustancia | Tipo de enlace | Tipo de partícula | Ejemplos |
|---|---|---|---|
| Iónica | Iónico | Cationes y aniones | CuSO4, KOH, NaNO3, MgO |
| Metálica | Metálico | Cationes (núcleo y electrones internos) y electrones externos móviles. | Co, Au, Fe, Ag |
| Molecular (covalente) | Covalente | Moléculas | O2, H2O, CCl4 |
| Covalente (redes) | Covalente (redes) | Átomos | C grafito, C diamante |
💡EXCEPCIONES.. AY BENDITAS EXCEPCIONES...💡
Viste que arriba hablamos de los tipos de enlaces según si se da entre metales y no metales? Bueno, tengo una hermosa excepción que quiero que aprendas (porque pueden llegar a tomarla en un examen):
El berilio (Be) es un metal alcalinotérreo y, en general, los metales combinados con no metales forman enlaces iónicos. ¡Ya sabemos eso! Sin embargo, el berilio es una excepción a esta regla general❌. Aunque es un metal, tiende a formar enlaces covalentes en lugar de enlaces iónicos. Esto tenés que saberlo bien porque a veces lo toman.😱😱😱
La razón de esto es que el berilio tiene solo dos electrones en su capa de valencia y necesita ocho para completar su octeto. Peeero, tiene una energía de ionización muy alta, lo que significa que le resulta muy difícil perder esos dos electrones para formar un ion positivo (que igual puede, pero es raaaaro). En cambio, tiende a compartir esos dos electrones con otros átomos, formando enlaces covalentes. O sea, el Berilio no va a querer formar cationes, el tipo quiere compartir, él quiere formar enlaces covalentes y eso va a hacer. Así que ya está Berilio, sé libre, rompé la única regla que este alumnado estaba comprendiendo y hacé lo que quieras. Jajjaja ke le pasaba
➡️ Otros conceptos que vamos a estudiar más adelante son:
Polaridad de enlace y momento dipolar de enlace: La polaridad de un enlace es una medida de la distribución desigual de la densidad electrónica entre los dos átomos involucrados en un enlace covalente. Ya sé, no entendiste, yo tampoco, a ver si te lo digo así:
Si los dos átomos involucrados en un enlace covalente tienen electronegatividades diferentes, ese enlace es polar, y tiene el electrón o los electrones del enlace desplazados hacia el átomo más electronegativo. El momento dipolar es una cantidad vectorial (una flechita) que mide la magnitud y la dirección de la polaridad del enlace. Todo esto va a cobrar sentido cuando veas los videos donde te lo explico, pero al menos te doy un pantallazo.
Si los dos átomos involucrados en un enlace covalente tienen electronegatividades diferentes, ese enlace es polar, y tiene el electrón o los electrones del enlace desplazados hacia el átomo más electronegativo. El momento dipolar es una cantidad vectorial (una flechita) que mide la magnitud y la dirección de la polaridad del enlace. Todo esto va a cobrar sentido cuando veas los videos donde te lo explico, pero al menos te doy un pantallazo.
Modelo de enlace de Lewis (estructuras de Lewis): Es una representación de los enlaces químicos en moléculas, donde se usan puntitos para representar electrones. O sea, son unos dibujitos que al principio los odias y después te parecen una ternura (o eso espero).
Regla del octeto: Esta regla dice que los átomos tienden a formar enlaces de manera que cada uno de ellos (con algunas excepciones que vemos en los videos) termine con ocho electrones en su capa de valencia, alcanzando una configuración electrónica similar a la de los gases nobles.
Ejemplos y excepciones: La mayoría de los elementos siguen la regla del octeto, como el carbono en el metano (CH4) o el oxígeno en el agua (H2O). Sin embargo, hay excepciones a esta regla, como los elementos del tercer período en adelante que pueden tener más de ocho electrones (hipervalencia) en su capa de valencia, como el azufre en el hexafluoruro de azufre (SF6), o los elementos con menos de cuatro electrones en su capa de valencia que no pueden alcanzar el octeto, como el berilio en el cloruro de berilio (BeCl2).
Espero que te sirva este resumen, podés volver acá cuando quieras. ¡Muchos ánimos y muchos éxitos!
🤖
¿Tenés dudas? Pregúntale a ExaBoti
Asistente de IA para resolver tus preguntas al instante🤖
¡Hola! Soy ExaBoti
Para chatear conmigo sobre este contenido necesitas desbloquear el curso

Confirmar eliminación
¿Estás segurx de que quieres eliminar este comentario? Esta acción no se puede deshacer.